问题描述:
(14分)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=—566kJmoL-1
2H2(g)+O2(g)=2H2O(g) △H=—483.6kJmoL-1
H2O(g)=H2O(l) △H=—44.0kJmoL-1
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:___________________________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol
2NH3(g) △H=—92.4kJ/mol
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

①图中t3时引起平衡移动的条件可能是__________________________________________,其中表示平衡混合物中NH3的含量最高的一段时间是_____________。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则反应在T℃时的平衡常数为____________mol-2·L2。
③目前工业合成氨的原理是:
下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。
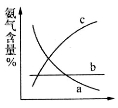
当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为_______>_______>_______>________。
(每空2分,共14分)(1)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ·mol-1(2)①升温 t2-t3 ②4 ③c a(3)c(Cl-)>c(NH4+)>c(H+)>c(OH-) (顺序正确得2分,顺序有误不得分)
分 析:
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=—566kJmoL-1,②2H2(g)+O2(g)=2H2O(g)△H=—483.6kJmoL-1,则根据盖斯定律可知(①—②)÷2即可得到CO和H2O(g)作用生成CO2和H2的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ·mol-1。(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:N2(g)+3H2(g)2NH3(g) △H=—92.4kJ/mol①t3时正逆反应速率均增大,其中逆反应速率大于正反应速率,平衡向逆反应方向进行。由于正方应是体积减小的放热的可逆反应,则引起平衡移动的条件是升高温度。平衡向正反应方向进行,氨气的含量高,因此根据图像可知表示平衡混合物中NH3的含量最高的一段时间是t2-t3。②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则根据方程式可知生成氨气是0.5mol×2=1.0mol,剩余氨气0.5mol,氢气2mol—1.5mol=0.5mol,则反应在T℃时的平衡常数为mol-2·L2。③目前工业合成氨的原理是:图表示随条件改变,平衡体系中氨气体积分数的变化趋势。当横坐标为压强时,增大压强平衡向正反应方向进行,氨气的含量升高,所以变化趋势正确的是c;当横坐标为温度时,升高温度平衡向逆反应方向进行,氨气的含量降低,则变化趋势正确的是a。(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,二者恰好反应生成氯化铵,铵根水解溶液显酸性,则所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为c(Cl-)>c(NH4+)>c(H+)>c(OH-) 。
考点:
考查盖斯定律、外界条件对平衡状态的影响、平衡常数计算以及浓度大小比较

