问题描述:
(1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.回答下列问题:
①开始加热一段时间后,试管___(填“A”或“B”)中会出现浑浊现象.
②实验现象证明,加热条件下,Na2CO3比NaHCO3更___(填“稳定”或“不稳定”).
(2)向炭粉、Cu和Fe2O3组成的混合粉末中加入一定量的稀硫酸,充分反应后过滤,得到溶液A,将沉淀物洗涤、干燥,得到固体B.
①溶液A中一定存在的金属阳离子是___.
②关于固体B的成分,下列选项中可能的有___.
A.炭粉 B.炭粉和Cu C.炭粉和Fe2O3 D.Cu和Fe2O3 E.炭粉、Cu和Fe2O3
③用___可以检验Fe3+的存在.若溶液中没有Fe3+,则一定与铜发生了化学反应,此反应的离子方程式为___.
(3)电解饱和食盐水是一项重要的化学工业,其反应原理为:2NaCl+2H2O
| 通电 |
完成下列计算:
①当电解产生0.2mol NaOH时,能收集到标准状况下的H2___L.
②电解生成的氯气和氢气可以化合生成氯化氢.某工厂每天电解585t食盐,若生成的氯气80%用于生产盐酸,每天最多可生产36.5%的盐酸___t.
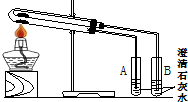
(1)①碳酸氢钠加热分解,而碳酸钠不能,由图可知,为体现对比小试管中应为碳酸氢钠,碳酸氢钠分解生成的二氧化碳使石灰水变浑浊,则B中出现浑浊,
故答案为:B;
②A中石灰水无变化,B中石灰水变浑浊,可知碳酸氢钠分解,碳酸钠不能,则加热条件下,Na2CO3比NaHCO3更稳定,
故答案为:稳定;
(2)氧化铁与硫酸反应生成硫酸铁和水,Cu与铁离子反应生成亚铁离子和铜离子;
①Cu足量时,溶液中含Fe2+、Cu2+,Cu不足时溶液中含Fe3+、Fe2+、Cu2+,则一定含的阳离子为Fe2+、Cu2+,故答案为:Fe2+、Cu2+;
②固体B中一定含碳,可能含Cu,若硫酸量很少,氧化铁可能剩余,则ABCE均可能,故答案为:ABCE;
③用硫氰酸钾溶液(或KSCN溶液)可以检验Fe3+的存在.若溶液中没有Fe3+,则一定与铜发生了化学反应,此反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:硫氰酸钾溶液(或KSCN溶液);2Fe3++Cu=2Fe2++Cu2+;
(3)①由2NaCl+2H2O
| 通电 |
| 1 |
| 2 |
②设每天最多可生产36.5%的盐酸为xt,
则2NaCl~Cl2~2HCl
2×58.5 2×36.5
585t×80% x×36.5%
| 2×58.5 |
| 2×36.5 |
| 585t×80% |
| x×36.5% |
解得x=800t,
故答案为:800.

